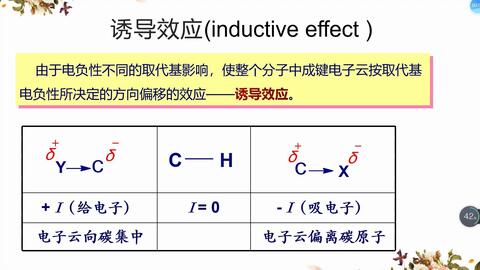
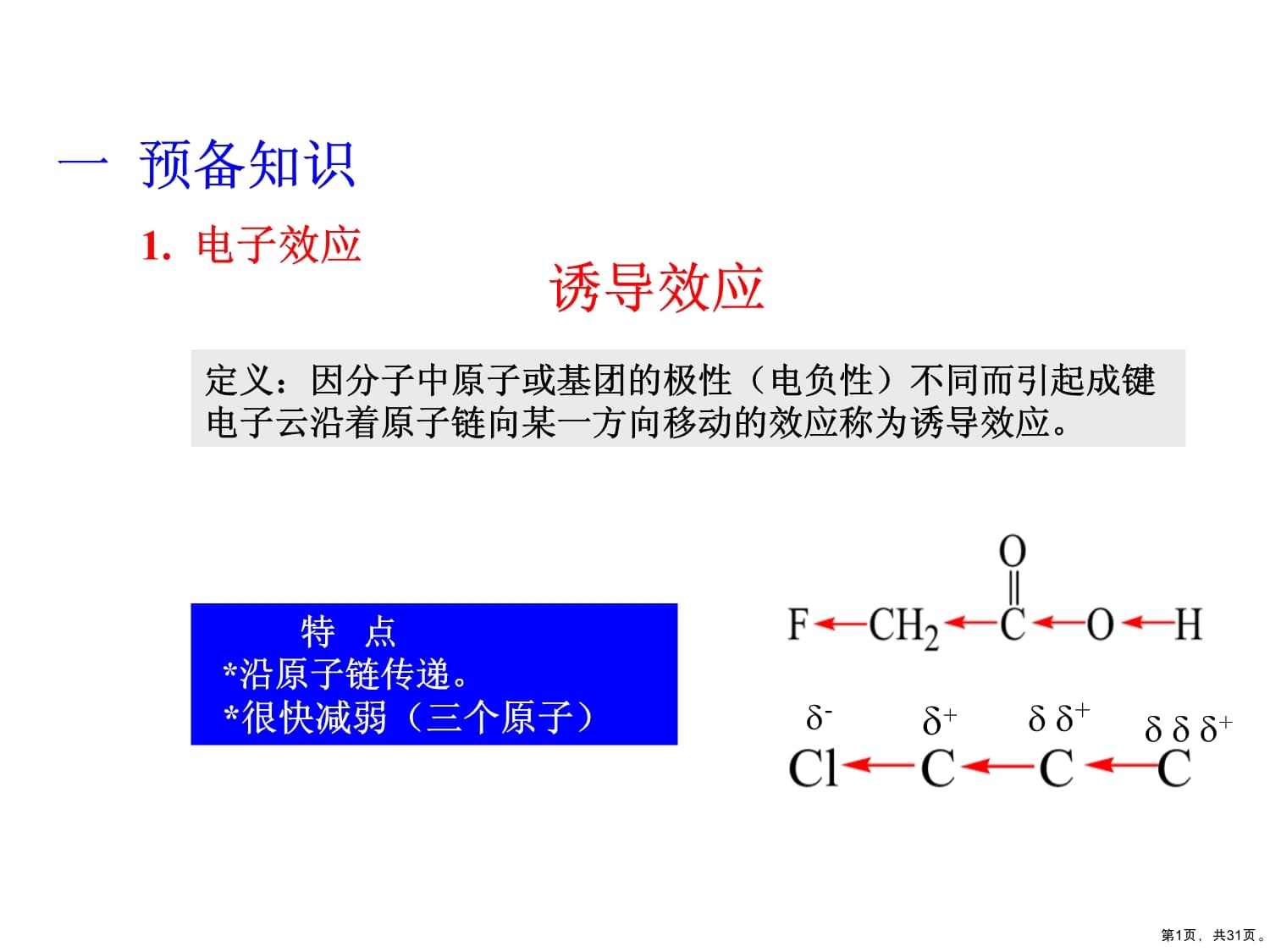
什么是电子对效应?一般取代基是吸电子效应还是给电子效应都有吸电子诱导效应。电子效应的热离子效应是在器件尺寸缩小的过程中,电源电压不能与器件尺寸同比例降低,导致mos器件内部电场增强,那么这个基团就有吸电子诱导效应,吸电子基团的公式是:负离子给电子,正离子吸电子。
1、有机化学请列举出常见基团的电子效应(勿抄
纠正你的一个观点。这些就够了。你要这么多干什么?竞争?不一定是这样。如果是非常复杂的分子,显然不仅仅是吸电子和吸电子的问题。你完全了解它的吸电子和吸电子效应是没有用的。显然,空间结构和共轭效应比它更重要。根据共轭效应和诱导效应的组合,氨基>甲氧基>羟基>苯基>甲基>磺酸基>硝基。
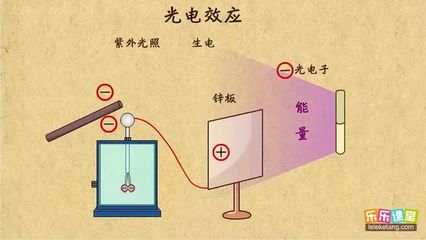
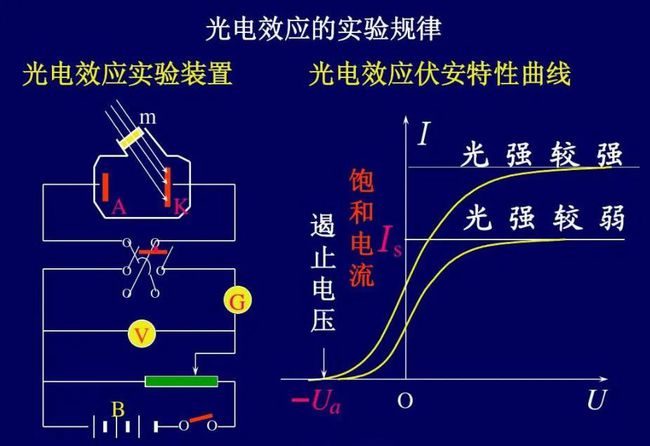
2、哪些是给电子基,哪些是吸电子基?
电子给体基团:对外界呈现负电场的基团。吸电子基团的分子式是:负离子给电子,正离子吸电子。单键氧、单键氮、单键硫等。是给电子体(共轭给电子体>诱导吸电子体)(如羟基、巯基、氨基、甲氧基、甲硫基、取代氨基等)。).与不饱和键直接相连的基团,如羰基(CO)、磺酰基(SO)等,是吸电子的(共轭的)。烷基供体(共轭的,超共轭的)。此外,如果卤离子直接连接到不饱和键上,则卤离子被诱导吸引电子并共轭给出电子。
3、碳碳双键是吸电子还是给电子
首先要知道有机化学中的取代基效应可以分为四类:诱导效应、共轭效应、超共轭效应和场效应。前两种是最常见的。一般来说,无论一个取代基是吸电子效应还是给电子效应,这两种效应的联合诱导效应(当然有些基团不具有共轭效应)都与原子的电负性有很强的关系,比如卤素原子,它具有吸电子诱导效应和F >。

电子引力越大,因为成键原子杂化轨道中S轨道分量越高,电子云引力越强,所以炔基的电子引力比烯基强。一般诱导效应转移的原子数最多为3,主要影响两个碳原子之间的距离。含P轨道或π键的体系存在共轭效应。如果基团的第一个碳原子与不饱和键相连,如苯基、羰基、醛基、硝基等。,则该基团具有电子吸引力。
4、电子对效应的基本概述
电子对该效应的解释很多,被认为是不完善的。1.在这些族中,随着原子半径的增大,价轨道延伸范围增大,轨道重叠减小;3.还认为成键原子内部电子增多(4d,4f…),排斥力增大,使平均键能降低。例如,GaCl3InCl3TlCl3的平均键能为b.e./kj mol。3.相对论效应被用来解释6s2惰性电子对效应。
5、什么是电子对效应???
元素周期表第4 . 5 . 6周期中P区的元素有保留低价态的倾向,不易形成最高价,称为惰性电子对效应。这种现象与长期以来所有民族元素的最高价态与民族数量相等的趋势并不协调。惰性电子对的作用在第六周期P区的元素中有突出的体现。例如,铊、铅和铋比价态更稳定。铊、铅和铋的氧化物和氟化物表现出高氧化态,而硫化物和卤化物只存在低氧化态。例如PbO2,

6、电子效应问题
我觉得你是想解释烯烃碳碳双键上的亲电加成规律,也就是马尔科夫法则。也就是说,当加成时,正部分被加成到双键碳原子的负电荷端,而负部分被加成到双键碳原子的正电荷端。我是这样理解的:CH3CHCH2,最右边的C原子结合了一个C和两个H,可能认为CC键是非极性的,所以两个CH键使这个C呈现-2价,中间的C结合了两个C和一个H,相当于-1价,所以右边的C原子更带负电,加成的只是正电部分,比如HCl中的H,H2O中的H。
显然,饥饿的oh越稀少,吸引的电子就越多。电负性指的是码吸引电子的能力。从元素周期表可以发现,越近的家族电负性越大。本质是电子云越靠近,越容易吸引原子核内核电荷越大的电子。电子云越松散,核电荷越小,电子越容易被电负性大的原子带走。7、电子效应的热电子效应
热电子效应是由于在器件尺寸缩小的过程中,电源电压不能与器件尺寸同比例降低,导致mos器件内部电场增强。当mos器件沟道中的电场强度超过100kv/cm时,电子在两次散射之间获得的能量可能超过它们损失的能量,从而使部分电子的能量明显高于热平衡时的平均动能,成为热电子。高能热电子会严重影响mos器件和电路的可靠性。
8、烃基推电子效应是什么
烃基是排斥电子的,相当于把它和氧原子共享的电子推给氧原子,而不是把O上的电子推给h,一般来说,烷基是(弱的,诱导的)给电子基团,烷基苯中有σ π超共轭,也是给电子的。烷基在气相中吸收电子并不矛盾,不同相态下物质的物理化学性质是不同的,就像hf在水溶液中是弱酸,在气相中是比硫酸更强的超酸一样,原则上,带有推电子取代基的乙烯基单体可以进行阳离子聚合。然而,阳离子聚合能否实际进行取决于取代基的推电子能力x0d的强度和形成的碳阳离子是否稳定,x0d乙烯没有取代基,无法进行阳离子聚合。x0d丙烯和丁烯上的甲基和乙基都是推电子基团,但只有一个x0d烷基的推电子能力很弱,所以生长速度很低,实际上只能得到低分子量的油。
